抗癌药物可以在光打开的分子笼中输送
帝国研究人员创造的分子笼可以导致更有针对性的癌症药物递送,从而提高效率和减少副作用。许多药物,包括癌症疗法,会在体内分解,这会降低它们的功效,并可能意味着需要更多的剂量。当它们损害健康组织时,它们也会引起副作用。
因此,研究人员正在寻找使药物更具针对性的方法,因此它们只有在到达身体的正确部位(例如癌症肿瘤部位)时才开始起作用。
现在,伦敦帝国理工学院化学系的研究人员为具有抗癌特性的分子创造了一种新型“笼子”。然后可以通过外部刺激(例如光)控制分子从笼子中的释放。该研究今天发表在Angewandte Chemie 上。
博士 学生 Timothy Kench 说:“我们对这种方法感到非常兴奋。通过调节小分子的生物活性,我们可以设计改进的疗法或研究特定的细胞过程。”
捕获药物分子
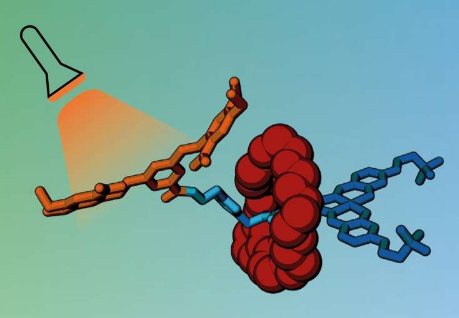
新笼子的工作原理是将药物分子“捕获”在无毒载体中,该载体可以在药物释放之前将药物运送到所需的部位。笼子由包裹药物的庞大分子团组成,阻止其生物活性,直到它们通过触发而分离。
为了制作笼子,该团队使用了一种特殊类型的分子,称为轮烷。轮烷有一个分子环,它被困在一个叫做轴的哑铃形部件上,它的两端都有塞子组,以防止环滑落。该环就像一个分子防护罩,阻止进入轴并防止它与其他分子相互作用。
研究人员设计一个轮烷与车轴包括生物活性分子,通常杀死肿瘤细胞通过与他们的DNA相互作用。当环存在时,活性分子不能与 DNA 结合,从而关闭其毒性。
然而,当暴露于光或特定酶时,轴的一端断裂,释放环并使活性分子与癌细胞中的 DNA 结合。
靶向癌症
结合到轮烷中的活性分子特别擅长与一种称为 G-四链体 (G4) 的特殊 DNA 结构相互作用。由于这些 DNA 结构在细胞中发挥的生物学作用,它们已被提议作为癌症的潜在药物靶点,这让科学家们希望能够与 G4 相互作用的化合物在未来可以用作新的抗癌药物。
研究人员首先使用从细胞中提取的 DNA 链测试了他们的新轮烷药物载体,发现根本没有相互作用,证实轮烷的环阻止了对活性化合物的访问。
接下来,他们在活的癌细胞中测试了他们的轮烷,首先表明负载有活性化合物的轮烷在正常条件下对这些细胞没有毒性。然而,当暴露在光线下时,几乎所有的癌细胞都在几个小时内死亡,这表明活性化合物可以以高度可控的方式在靶向癌细胞内释放。
使用共聚焦显微镜追踪癌细胞中的轮烷表明,在光照之前,它仍留在细胞的外部,其中不含 DNA。然而,当光线照射到细胞上后,释放的活性分子就会移动到细胞核中,细胞中的大部分 DNA 都储存在那里。这些实验表明,正是由于与 DNA 的触发结合导致癌细胞死亡。
Ramon Vilar 教授说:“能够在正确的地点和时间输送药物是药物化学中的一个重要挑战。我们的研究表明,可以通过将活性分子束缚在轮烷中来实现这一目标。”
虽然就其位置和强度的控制程度而言,光是一个很好的触发因素,但在实际使用中,它仅限于皮肤癌或可能通过内窥镜到达体内的皮肤癌。因此,研究人员还在测试使用特定酶释放轮烷环的可能性,例如仅在癌细胞中大量发现的酶。杰米刘易斯博士说:
用于制备这些轮烷的“点击反应”是简单且模块化的反应,可以连接积木,如分子乐高套件。这很棒,因为您可以将各种不同的分子‘点击’在一起,使我们的方法非常通用和适应性强。”
他们方法的模块化将允许研究人员使用不同的抗癌分子或引入替代激活机制。实际上,研究人员可以选择他们想要的组件,然后使用相同的过程将它们单击在一起。
标签: 抗癌药物
